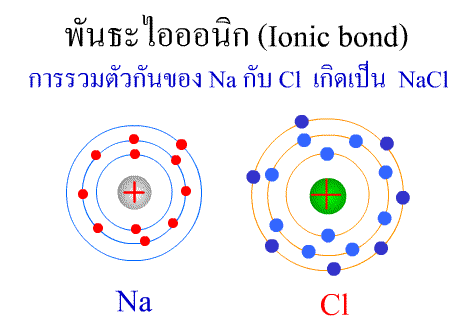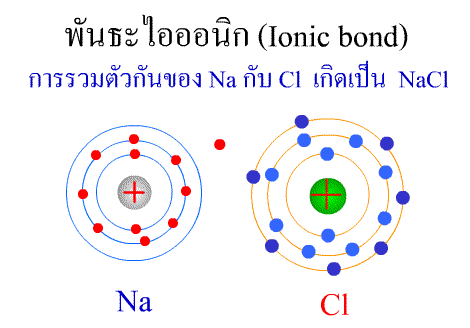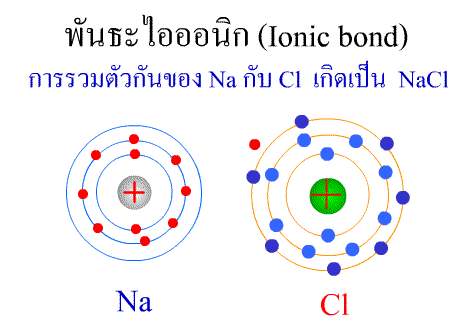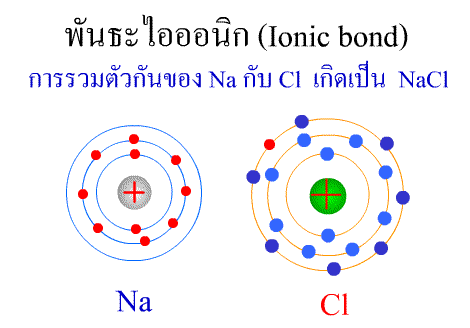
ทฤษฎีกรด–เบส

สีของสารละลายกรดที่ pH ต่างๆ โดยมีน้ำกระหล่ำปลีแดงคั้นเป็นอินดิเคเตอร์
นิยามของอาร์รีเนียส
สเวนเต อาร์รีเนียส (Svante Arrhenius) นักเคมีชาวสวีเดนได้ให้คำจำกัดความของกรดและเบสขึ้น ในปี พ.ศ. 2427 โดยเกี่ยวข้องกับความเข้มข้นของไฮโดรเจนไอออน (H+) หรือ ไฮโดรเนียมไอออน (H3O+) และไฮดรอกไซด์ไอออน (OH−) เมื่อสารนั้นๆละลายน้ำ โดยระบุว่า "กรด หมายถึง สารที่ละลายน้ำแล้วแตกตัวทำให้ความเข้มข้นของไฮโดรเจนไอออนหรือไฮโดรเนียมไอออนเพิ่มขึ้น" และ "เบส หมายถึง สารที่ละลายน้ำแล้วแตกตัวทำให้ความเข้มข้นของไฮดรอกไซด์ไอออนเพิ่มขึ้น"
สเวนเต อาร์รีเนียส (Svante Arrhenius)
การแตกตัวในน้ำของกรด
HCl (aq) → H+ (aq) + Cl− (aq)
การแตกตัวในน้ำของเบส
NaOH (aq) → Na+ (aq) + OH− (aq)
อย่างไรก็ตาม น้ำบริสุทธิ์ จะมีสมบัติเป็นกลาง เนื่องจากการแตกตัวด้วยตัวเอง (Auto-dissociation) ของน้ำจะอยู่ในสภาวะสมดุลระหว่างความเข้มข้นของ (H3O+) และ (OH−) ซึ่งมีค่าเท่ากัน ดังนั้น การละลายน้ำของสารที่เป็นกรดตามนิยามของอาร์รีเนียสจึงไปทำให้ความเข้มข้นของไฮโดรเจนไอออนเพิ่มขึ้น อนึ่ง เนื่องจากไฮโดรเจนไอออน (H+) เป็นไอออนที่มีอนุภาคมูลฐานเป็นโปรตอนเพียงตัวเดียว นักเคมีจึงนิยมเรียกว่า โปรตอน ทั้งนี้ หากโปรตอนละลายอยู่ในน้ำก็อาจจะเขียนแทนได้เป็น (H3O+) ที่เกิดจากการรวมตัวของโปรตอนกับโมเลกุลของน้ำ
สมการการแตกตัวด้วยตัวเองของน้ำ:
H2O(l) + H2O(l) ⇌ H3O+(aq) + OH−(aq)
ปัญหาที่สำคัญของทฤษฎีกรด-เบสของอาร์รีเนียส คือ ไม่สามารถระบุความเป็นกรด-เบสของสารที่ไม่ละลายน้ำได้ และไม่สามารถระบุความเป็นกรดที่ไม่มีไฮโดรเจนได้ เช่น AlCl3หรือเบสที่ไม่มีไฮดรอกไซด์ไอออน เช่น NH3 หรือ N(CH3)3 ได้ จึงมีการนิยามขึ้นใหม่โดยนักเคมีรุ่นหลังอ่านต่อ>>



 และเรียกจำนวน อนุภาคนี้ว่า 1 โมล และเลขจำนวนนี้เรียกว่า เลขอาโวกาโดร (Avogadro' number)
และเรียกจำนวน อนุภาคนี้ว่า 1 โมล และเลขจำนวนนี้เรียกว่า เลขอาโวกาโดร (Avogadro' number) อนุภาค
อนุภาค
 นี้เเรียกว่า เลข อาโวกาโดร
นี้เเรียกว่า เลข อาโวกาโดร
 ถ้าเป็นโมเลกุล 1 โมล(โมเลกุล) ก็จะมีจำนวนโมเลกุล เท่ากับ 6.02
ถ้าเป็นโมเลกุล 1 โมล(โมเลกุล) ก็จะมีจำนวนโมเลกุล เท่ากับ 6.02 
 เช่นกัน
เช่นกัน CCl4
CCl4 CCl4
CCl4 CCl4
CCl4 6.02
6.02 
 อะตอม 4
อะตอม 4  6.02
6.02 
 อะตอม 1
อะตอม 1  6.02
6.02 
 โมเลกุล
โมเลกุล